🖍❌Para quem tomou mais de uma dose de vacina contra COVID🖍❌
P O R A M O R A O P R Ó X I M O
——————————
Se cada um enviar pra 30 contatos em segundos serão milhões de vidas salvas. É dessa solidariedade que a mídia paga, o STF e TSE tem medo, medo do povo brasileiro unido.
—————————-
1 – A IVERMECTINA evita os danos provocados pelas Vacinas RNA.
2 – A IVERMECTINA bloqueia a entrada da Proteína Spike para dentro das células. Então, se a pessoa foi vacinada, tem uma esperança, tem uma forma de se tratar através da Ivermectina.
3 – A IVERMECTINA faz tratamento pós Covid e pós vacinal, é um medicamento eficaz em todas as fases da Covid 19, antes mesmo de entrar na célula a IVERMECTINA já destrói o vírus no sangue. Ela só tem efeitos benéficos e nenhum maléfico no tratamento do coronavírus.
4 – A IVERMECTINA tem ação anti-inflamatória muito potente no Coronavírus.
5 – A IVERMECTINA tem ação potente para lesões traumáticas e ortopédicas, e sem os efeitos colaterais dos corticoides.
6 – A IVERMECTINA trata doenças autoimunes como: artrite reumatoide, espondilite anquilosante, fibromialgia, psoríase, doença de Crohn, rinite alérgica.
7 – A IVERMECTINA reduz a frequência de gripes e resfriados.
8 – A IVERMECTINA melhora a imunidade de pacientes cancerosos.
9 – A IVERMECTINA trata Herpes Simplex e Herpes Zoster.
10 – A IVERMECTINA reduz frequência de sinusites e diverticulites.
11 – A IVERMECTINA protege o coração numa sobrecarga cardíaca, numa embolia por exemplo ela evita a hipóxia cardíaca porque ela estimula a produção de energia básica para que o tecido não seja destruído e melhora assim a função cardíaca.
12 – A IVERMECTINA é antiparasitária.
13 – A IVERMECTINA é antineoplásica (anticancerígena), suprime a proliferação e metástase das células cancerosas matando apenas as células cancerosas e preservando as células sadias, melhorando a eficácia do tratamento quimioterápico, pois mata as células cancerosas resistentes à quimioterapia, vencendo a resistência a múltiplos quimioterápicos que os tumores desenvolvem, e combinada com a quimioterapia e/ou anticancerígenos, ela proporciona o aumento da eficácia desses tratamentos.
14 – A IVERMECTINA é antimicrobiana (bactérias e vírus), e aumenta a imunidade.
15 – A IVERMECTINA tem capacidade fantástica de regeneração dos nervos.
16 – A IVERMECTINA regula o metabolismo da glicose e da insulina.
17 – A IVERMECTINA regula o metabolismo do colesterol.
18 – A IVERMECTINA reduz gordura hepática na esteatose.
19 – A IVERMECTINA protege o fígado exposto à inseticidas.
20 – A IVERMECTINA ataca o vírus em todos os lugares em que ele estiver, independente das mutações.
21 – A IVERMECTINA serve para a prevenção e para o tratamento do coronavírus, de forma surpreendente. Eficácia não comprovada não é da Ivermectina, e sim das vacinas.
22 – A IVERMECTINA, usada como agente profilático, foi associada à redução significativa das taxas de infecção, hospitalização e mortalidade por COVID-19.
23 - A IVERMECTINA não agride o fígado, pois não é metabolizada nele, e sim no intestino, pelo contrário, ela protege o fígado.
________________
Como tomar a Ivermectina, de modo preventivo:
1 comprimido de 6mg para cada 30 kg de peso em dose única e repetir esta dose mensalmente. Agora se estiver sentindo algum sintoma, tome essa mesma dosagem diariamente, por 3 a 5 dias seguidos.
Tomar a Ivermectina após ingerir alimentos, pois aumenta em 2,5 vezes a sua absorção.
É um medicamento barato e foi retirado das farmácias na pandemia por governadores e prefeitos ladrões e assassinos interessados nas generosas propinas distribuídas pelos fabricantes das vacinas.
DIVULGUE. VAMOS SALVAR VIDAS!
POR AMOR AO PRÓXIMO; SEM ACEPÇÃO DE PESSOAS INCLUSIVE O "GOVERNO" PORQUE O AMOR NÃO TEM FRONTEIRAS
A S S U N T A B R A S I L !
O estudo foi publicado no Cureus Journal of Medical Science e pode ser checado no link abaixo:
https://www.cureus.com/articles/82162-ivermectin-prophylaxis-used-for-covid-19-a-citywide-prospective-observational-study-of-223128-subjects-using-propensity-score-matching
P O R A M O R A O P R Ó X I M O
——————————
Se cada um enviar pra 30 contatos em segundos serão milhões de vidas salvas. É dessa solidariedade que a mídia paga, o STF e TSE tem medo, medo do povo brasileiro unido.

Profilaxia com ivermectina usada para COVID-19: um estudo prospectivo e observacional em toda a cidade de 223.128 indivíduos usando correspondência de pontuação de propensão
Publicado: 15 de janeiro de 2022
DOI: 10.7759/cureus.21272 ![]()
 Revisado por pares
Revisado por paresComo citar este artigo: Kerr L, Cadegiani FA, Baldi F, et al. (15 de janeiro de 2022) Profilaxia com ivermectina usada para COVID-19: um estudo observacional prospectivo em toda a cidade de 223.128 indivíduos usando correspondência de pontuação de propensão. Cureus 14(1): e21272. doi:10.7759/cureus.21272
Abstrato
Antecedentes: A ivermectina demonstrou diferentes mecanismos de ação que potencialmente protegem contra a infecção pela doença coronavírus 2019 (COVID-19) e comorbidades relacionadas ao COVID-19. Com base nos estudos que sugerem eficácia na profilaxia combinada com o perfil de segurança conhecido da ivermectina, um programa de prevenção municipal usando ivermectina para COVID-19 foi implementado em Itajaí, uma cidade do sul do Brasil, no estado de Santa Catarina. O objetivo deste estudo foi avaliar o impacto do uso regular de ivermectina na infecção subsequente por COVID-19 e nas taxas de mortalidade.
Materiais e métodos: Analisamos dados de um estudo prospectivo e observacional do programa municipal de prevenção da COVID-19 com ivermectina, realizado entre julho de 2020 e dezembro de 2020 em Itajaí, Brasil. O desenho do estudo, a aprovação do conselho de revisão institucional e a análise dos dados de registro ocorreram após a conclusão do programa. O programa consistiu em convidar toda a população de Itajaí para uma consulta médica para se inscrever no programa e compilar informações básicas, pessoais, demográficas e médicas. Na ausência de contraindicações, a ivermectina foi oferecida como tratamento opcional a ser tomada por dois dias consecutivos a cada 15 dias na dose de 0,2 mg/kg/dia. Nos casos em que um cidadão de Itajaí participante adoeceu com COVID-19, foi orientado a não usar ivermectina ou qualquer outro medicamento no tratamento ambulatorial precoce. Os resultados clínicos de infecção, hospitalização e morte foram relatados automaticamente e inseridos no registro em tempo real. A análise do estudo consistiu na comparação de usuários de ivermectina com não usuários, usando coortes de escore de propensão de pacientes infectados, pareados por idade, sexo e comorbidades. As taxas de infecção e mortalidade por COVID-19 foram analisadas com e sem o uso do pareamento por escore de propensão (PSM).
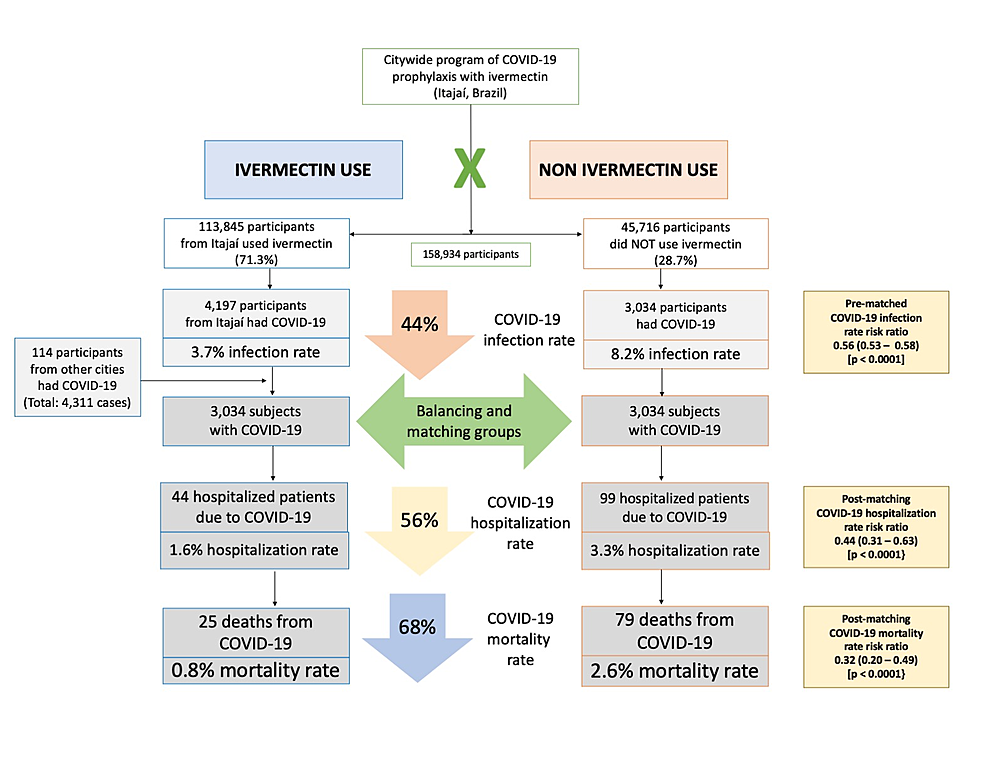
Resultados: Dos 223.128 cidadãos de Itajaí considerados para o estudo, foram incluídos na análise um total de 159.561 sujeitos: 113.845 (71,3%) usuários regulares de ivermectina e 45.716 (23,3%) não usuários. Destes, 4.311 usuários de ivermectina foram infectados, sendo 4.197 procedentes da cidade de Itajaí (3,7% de taxa de infecção), e 3.034 não usuários (de Itajaí) foram infectados (6,6% de taxa de infecção), com redução de 44% na COVID -19 taxa de infecção (razão de risco [RR], 0,56; intervalo de confiança de 95% (IC 95%), 0,53-0,58; p < 0,0001). Usando PSM, foram comparadas duas coortes de 3.034 indivíduos que sofrem de infecção por COVID-19. O uso regular de ivermectina levou a uma redução de 68% na mortalidade por COVID-19 (25 [0,8%] versus 79 [2,6%] entre não usuários de ivermectina; RR, 0,32; IC 95%, 0,20-0,49; p < 0,0001) . Quando ajustado pelas variáveis residuais, a redução na taxa de mortalidade foi de 70% (RR, 0,30; IC 95%, 0,19-0,46; p < 0,0001). Houve uma redução de 56% na taxa de hospitalização (44 versus 99 hospitalizações entre usuários e não usuários de ivermectina, respectivamente; RR, 0,44; IC 95%, 0,31-0,63; p < 0,0001). Após ajuste para variáveis residuais, a redução na taxa de hospitalização foi de 67% (RR, 0,33; IC 95%, 023-0,66; p < 0,0001).
Conclusão: Neste grande estudo de PSM, o uso regular de ivermectina como agente profilático foi associado a taxas significativamente reduzidas de infecção, hospitalização e mortalidade por COVID-19.
Introdução
Foi demonstrado que a ivermectina tem não apenas extensas ações antiparasitárias [1,2] , mas também propriedades antivirais, antibacterianas e antiprotozoárias. A ivermectina tem sido proposta há muito tempo para uso como agente antiviral reaproveitado [3-6] . Na verdade, os efeitos antivirais da ivermectina foram relatados contra tipos de vírus de RNA e DNA, incluindo HIV-1, febre amarela, encefalite japonesa, encefalite transmitida por carrapatos, Nilo Ocidental, Zika, dengue, chikungunya, encefalite equina venezuelana e o vírus da pseudo-raiva [3,5,7,8] , além de atuar na regulação de proteínas envolvidas nas respostas antivirais [8] .
As ações adicionais descritas da ivermectina incluem atividade de agonismo no receptor X do fígado (LXR) e no receptor X farnesóide (FXR), com múltiplos benefícios metabólicos potenciais [9,10] ; regeneração neuronal [11,12] , prevenção da hipóxia muscular [13] e ações em locais específicos, incluindo interferon (INF) [14] , fator nuclear-κB (NF-κB), lipopolissacarídeo (LPS) [15] e Janus quinase/transdutor de sinal e ativador de transcrição (JAK-STAT) e via PAI-1 [16,17] ; geração de quinase 1 ativada por P21 (PAK-1) [18,19] ; redução dos níveis de interleucina-6 (IL-6) [15] ; modulação alostérica do receptor P2X4 [20] ; inibição da caixa 1 do grupo de alta mobilidade (HMGB1) [21,22] ; e supressão da hipersecreção de muco, diminuição do recrutamento de células imunes e produção de citocinas no pulmão [23] . A ivermectina também é descrita como indutora de resposta imune do tipo T helper 1 (Th1) contra infecções por protozoários [24] e ação anticoagulante através da ligação à proteína S de alguns vírus [25] .
A hipótese de que a ivermectina poderia ser protetora contra a doença do coronavírus 2019 (COVID-19) é fundamentada por suas múltiplas vias, efeitos antiinflamatórios [15,26] e mecanismos multiantivirais. A patogênese da COVID-19 é amplamente compreendida como uma infecção hemaglutinante mediada por inflamação que perturba os sistemas pulmonar, vascular e endotelial, levando a uma doença multissistêmica. In vitro e in silico, a ivermectina demonstrou atividade anti-síndrome respiratória aguda grave coronavírus 2 através de mais de 20 mecanismos diretos e indiretos [2,27,28] .
A ivermectina demonstrou efeitos protetores preliminares contra a infecção pelo coronavírus 2 da síndrome respiratória aguda grave (SARS-CoV-2) em termos de redução do tempo de recuperação clínica e das taxas de progressão da doença e mortalidade [2,29,30] . No entanto, estudos mais robustos e com amostras maiores ainda são recomendados para confirmar os possíveis efeitos benéficos da ivermectina na COVID-19.
Desde o início da pandemia de COVID-19, o uso de opções baratas baseadas em um sinal de eficácia consistentemente benéfico, um perfil de segurança bem estabelecido e uma relação custo-efetividade favorável, a ivermectina é uma intervenção altamente atraente para a medicina centrada no paciente praticada por médicos da linha de frente, com uso alinhado fortemente com os princípios bioéticos para a prática médica descritos no Artigo 36 da Declaração de Helsinque [31] .
No entanto, apesar deste perfil de risco/benefício favorável e da ausência de alternativas terapêuticas, a ivermectina ainda não foi aprovada para profilaxia e tratamento da COVID-19 por agências em todo o mundo, incluindo FDA (EUA), Agência Europeia de Medicamentos (EMA; Europa), e ANVISA (Agência Nacional de Vigilância Sanitária; Brasil).
A capacidade de prescrever ivermectina ou qualquer outro medicamento off-label para a COVID-19 está há muito tempo a critério dos médicos da linha de frente, uma vez que todos os riscos, incertezas, benefícios potenciais e direitos dos pacientes sejam expostos e o consentimento informado tenha sido obtido. Vale ressaltar que, no Brasil, isso segue a autonomia médica para determinar as melhores estratégias terapêuticas para os indivíduos, conforme o Código de Ética Médica do Conselho Médico Brasileiro, do Conselho Federal de Medicina - Conselho Federal de Medicina (CFM), que determina as obrigações e direitos dos médicos no Brasil [32] .
Como as vacinas para a COVID-19 não estavam disponíveis no Brasil até 2021, e devido à falta de alternativas profiláticas na ausência de vacinas, Itajaí, uma cidade no estado de Santa Catarina, no sul do Brasil, iniciou um programa governamental para toda a população contra a COVID -19 profilaxia. Os parâmetros de decisão com foco médico estabelecidos baseiam-se na distribuição de ivermectina para populações inteiras em diferentes países. Para garantir a segurança da população, foi desenvolvido um programa de computador bem controlado para compilar e manter todos os dados demográficos e clínicos relevantes (detalhados na seção Materiais e Métodos). O uso de ivermectina foi opcional e baseado nas preferências dos pacientes, visto que seus benefícios como agente preventivo não foram comprovados.
O objetivo deste estudo é avaliar o impacto em resultados clínicos importantes quando a ivermectina é usada como profilaxia para COVID-19. O programa de profilaxia ocorreu em complemento às estratégias não farmacológicas padrão de mascaramento e distanciamento social, como parte de um programa municipal realizado em regime ambulatorial.
Materiais e Métodos
População do estudo
Este foi um estudo prospectivo e observacional. Embora o desenho do estudo, a aprovação do conselho de revisão institucional (IRB) e a análise de dados tenham ocorrido após a conclusão do programa de profilaxia voluntária, todos os dados foram coletados prospectivamente em tempo real, com notificação obrigatória ao registro de todos os eventos que ocorreram durante a pandemia governamental de COVID-19 em toda a cidade. 19 programa de prevenção com ivermectina, de julho de 2020 a dezembro de 2020, desenvolvido na cidade de Itajaí, no estado de Santa Catarina, Brasil. Os dados demográficos e clínicos foram relatados a partir de prontuários de pacientes acompanhados em um ambulatório de grande porte (um ambulatório provisório instalado no Centro de Convenções de Itajaí) e em diversos ambulatórios secundários, como parte do Sistema Único de Saúde (SUS). ]).
O objetivo foi determinar o número de pacientes afetados por COVID-19 (taxa de positividade da reação em cadeia da polimerase com transcrição reversa [RT-PCR] para SARS-CoV-2), risco de morte por COVID-19 (infectados ou não ) e taxa de mortalidade por COVID-19 (risco de morte por COVID-19) daqueles que usaram e não usaram ivermectina profilaticamente para COVID-19. Esses dados foram estratificados por idade, sexo, presença de comorbidades e características demográficas correlacionadas.
A presente análise retrospectiva dos dados coletados prospectivamente foi aprovada pelo Conselho Nacional de Ética em Pesquisa (CONEP) sob o número 4.821.082 com o número do projeto CAAE: 47124221.2.0000.5485. Embora o desenho do estudo, a aprovação do IRB e a análise de dados tenham ocorrido após a conclusão do programa de profilaxia voluntária, todos os dados foram coletados prospectivamente em tempo real, com notificação obrigatória ao registro de todos os eventos que ocorreram durante a prevenção governamental da COVID-19 em toda a cidade com ivermectina programa, de 7 de julho de 2020 a 2 de dezembro de 2020, desenvolvido na cidade de Itajaí, no estado de Santa Catarina, Brasil.
Procedimentos de estudo e coleta de dados
O uso profilático opcional e voluntário de ivermectina foi oferecido aos pacientes durante consultas médicas regulares entre 7 de julho de 2020 e 2 de dezembro de 2020, em 35 locais diferentes, incluindo 34 centros de saúde locais do SUS e um grande ambiente temporário para pacientes, 24 horas por dia, 7 dias por semana. Os médicos que trabalhavam nesses locais eram livres para prescrever ivermectina profilaticamente. Os indivíduos que não usaram ivermectina recusaram ou seus médicos de atenção primária optaram por não oferecer ivermectina.
Para evitar subnotificação de dados, foi seguido um sequenciamento rigoroso de procedimentos: (1) registro e registro dos dados do paciente, documentados pelos auxiliares; (2) pesagem dos sujeitos (o peso do sujeito foi essencial para calcular a dose adequada de ivermectina); (3) breve avaliação médica da história médica pregressa, comorbidades, uso de medicamentos e contraindicações a medicamentos; e (4) prescrição médica com doses profiláticas de ivermectina (dentro das doses usuais e seguras recomendadas de ivermectina), de acordo com o julgamento médico e seguindo o consentimento informado do sujeito relacionado aos potenciais benefícios, riscos e efeitos colaterais. Todos os detalhes deste programa e campanha municipal foram previamente acordados entre o departamento local do Sistema Único de Saúde (SUS), o prefeito da cidade e os promotores públicos locais.
Em relação às interações medicamentosas com ivermectina, o uso de varfarina foi contraindicação para profilaxia com ivermectina devido às interações medicamentosas. Indivíduos sob uso crônico de glicocorticóides, inibidores de protease e antiepilépticos foram recomendados a agendar consultas médicas regulares a cada seis a oito semanas. Foi recomendado aos indivíduos que informassem os médicos sobre o uso de ivermectina, caso um ou mais dos seguintes medicamentos fossem prescritos: varfarina, azitromicina, dexametasona, prednisona ou prednisolona (hidrocortisona ou cortisona não estão disponíveis comercialmente em farmácias regulares no Brasil).
Foram analisadas as seguintes variáveis: (1) idade, (2) sexo, (3) doenças prévias (infarto do miocárdio [IM] e acidente vascular cerebral), (4) comorbidades pré-existentes (diabetes tipo 2 [DT2], asma, obstrução crônica doença pulmonar [DPOC], hipertensão, dislipidemia, doenças cardiovasculares [DCV], câncer [qualquer tipo] e outras doenças pulmonares) e (5) tabagismo. As variáveis foram ajustadas como fatores de confusão e utilizadas como variáveis para balanceamento e pareamento de grupos para pareamento por escore de propensão (PSM).
Foram excluídos da amostra pacientes que apresentaram sinais ou diagnóstico de COVID-19 antes de 7 de julho de 2020. Outros critérios de exclusão foram contraindicações à ivermectina e indivíduos com idade inferior a 18 anos. A dose e frequência do tratamento com ivermectina foi de 0,2 mg/kg/dia; ou seja, administrar um comprimido de 6 mg para cada 30 kg durante dois dias consecutivos a cada 15 dias.
Durante o estudo, os indivíduos que foram diagnosticados com COVID-19 foram submetidos a uma consulta médica específica para avaliar as manifestações clínicas e a gravidade da COVID-19. Todos os indivíduos foram recomendados a não usar ivermectina, nitazoxanida, hidroxicloroquina, espironolactona ou qualquer outro medicamento considerado eficaz contra a COVID-19. A cidade não forneceu nem apoiou nenhum tratamento farmacológico ambulatorial específico para indivíduos infectados com COVID-19.
Eles foram questionados quanto à presença de sintomas comuns de COVID-19. Estes incluíram calafrios, febre alta, tosse, mialgia, fadiga, anosmia, ageusia, dor de garganta, dor de cabeça, congestão nasal, espirros, coriza, hemoptise, náuseas, vômitos, dor abdominal, diarréia, erupção cutânea, artralgia, dor no peito. , dor ocular e conjuntivite e presença de sinais de alerta, incluindo falta de ar, sinais de hipóxia, sinais de anormalidades de coagulação e alteração do nível de consciência. Foram medidas pressão arterial sistólica e diastólica, frequência cardíaca, frequência respiratória, saturação de oxigênio e temperatura axilar. Os mesmos sinais e sintomas e sinais vitais foram coletados em cada consulta médica seguinte durante a COVID-19. Os dados individuais foram compilados e revisados pelos pesquisadores.
Foram revisados os dados cadastrais de todos os prontuários de pacientes da cidade de Itajaí entre 7 de julho de 2020 e 2 de dezembro de 2020, incluindo aqueles que usaram ivermectina e não usaram ivermectina. Foram considerados para esta análise todos os sujeitos que testaram positivo para COVID-19 na cidade de Itajaí durante o estudo. Dos indivíduos infectados, foram considerados dois grupos: indivíduos que usaram ivermectina profilaticamente (grupo tratado) e indivíduos que não usaram ivermectina profilaticamente (grupo não tratado). Os dados faltantes dos pacientes foram esclarecidos diretamente com os pacientes ou familiares, por telefone ou pessoalmente, pelos investigadores. Por se tratar de um programa municipal, todos os dados registrados devem corresponder ao número exato de casos e mortes de COVID-19 na cidade. Este intervalo estrito evita diferenças em termos de períodos de exposição.
Devido à incerteza da reinfecção com COVID-19, indivíduos com histórico de COVID-19 anterior não participaram do programa, embora ainda tivessem permissão para usar ivermectina profilaticamente. Os parâmetros limitantes do sistema governamental permitiram o registro apenas de um primeiro episódio de infecção por COVID-19. Indivíduos com menos de 18 anos e indivíduos com diagnóstico de COVID-19 antes de 7 de julho de 2020 foram excluídos de todos os conjuntos de dados e análises.
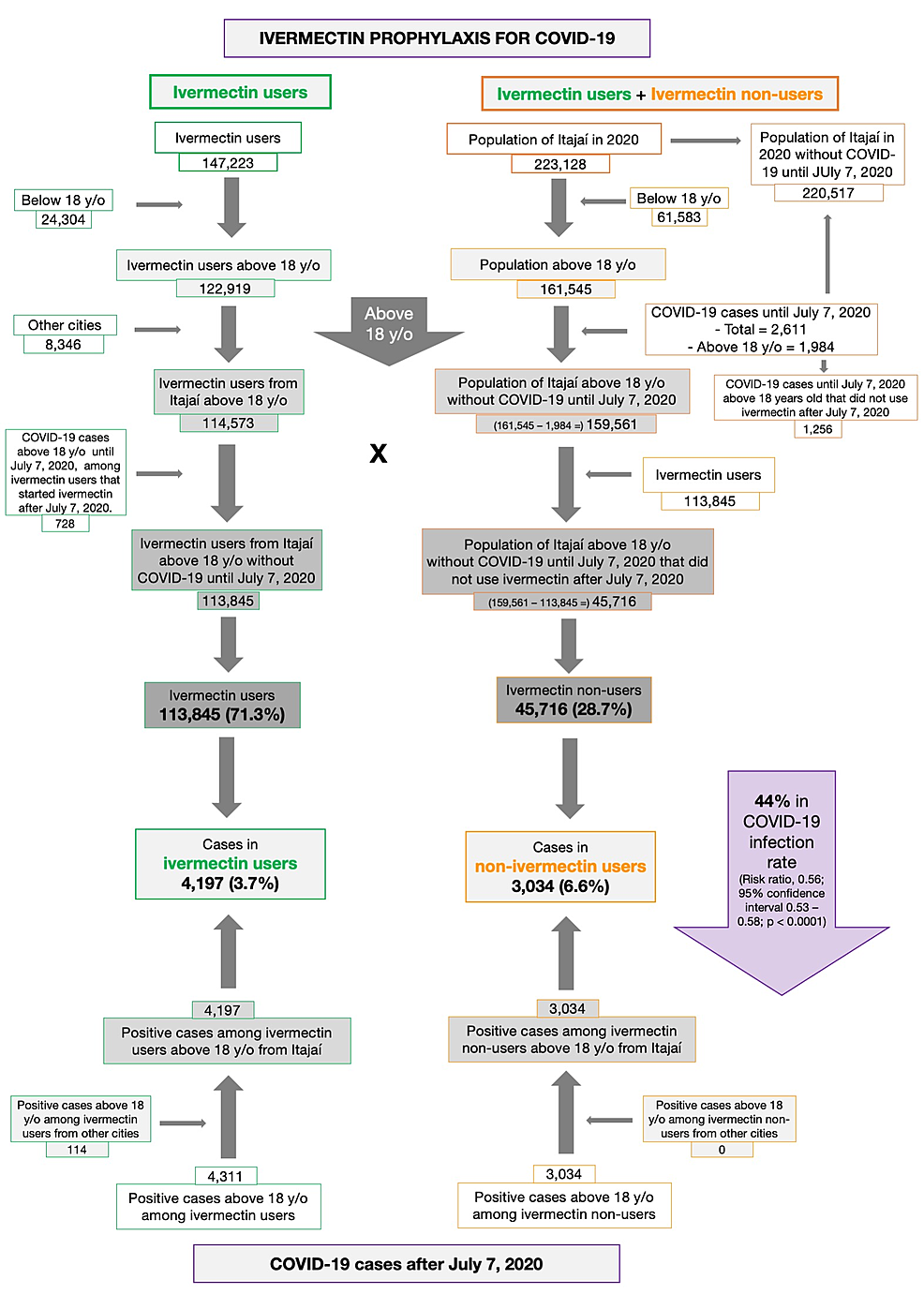
Do cadastro da população do município (223.128 habitantes), foram retirados os menores de 18 anos (61.583 sujeitos). Dos 161.545 sujeitos acima de 18 anos da cidade de Itajaí, removemos os 1.984 casos de COVID-19 ocorridos antes de 7 de julho de 2020, restando 159.561 sujeitos. Foram considerados indivíduos maiores de 18 anos aqueles que nasceram antes de 30 de junho de 2002.
Um total de 147.223 indivíduos participaram do programa de profilaxia com ivermectina utilizado para COVID-19. Destes, 24.304 indivíduos tinham menos de 18 anos. Dos 122.919 usuários de ivermectina acima de 18 anos, 8.346 eram de outras cidades e 728 tiveram COVID-19 antes de 7 de julho de 2020, embora tenham usado ivermectina posteriormente. No total, 113.845 sujeitos que participaram do programa permaneceram no conjunto de dados. Os 45.716 não participantes, restantes sujeitos entre os 159.561 sujeitos, foram considerados como não usuários de ivermectina.
Por fim, as taxas de hospitalização e mortalidade por COVID-19 em toda a cidade de Itajaí foram comparadas entre o período antes do programa (antes de 7 de julho de 2020) e durante o programa (entre 7 de julho de 2020 e 2 de dezembro de 2020) com o objetivo de avaliar se um programa da profilaxia com ivermectina para COVID-19 causaria impacto positivo nos números gerais da cidade, apesar da adoção apenas parcial. As chances de morte por COVID-19 na população geral, de acordo com o uso ou não de ivermectina (independentemente da infecção por COVID-19), foram calculadas apenas antes da comparação. Por outro lado, a taxa de mortalidade entre aqueles que foram infectados pelo SARS-CoV-2 foi calculada para coortes pré e pós-pareadas.
As taxas de hospitalização e mortalidade antes dos grupos correspondentes, a taxa de mortalidade em subpopulações antes e depois do PSM e a lista de verificação de Fortalecimento do Relatório de Estudos Observacionais em Epidemiologia (STROBE) são apresentadas no Apêndice.
Análise estatística
Os dados completos subjacentes à presente análise foram analisados por dois estatísticos independentes e as discrepâncias foram avaliadas por um terceiro especialista em estatística. Neste estudo ambulatorial daqueles que testaram positivo para SARS-CoV-2, a taxa de mortalidade foi avaliada de acordo com cada parâmetro que foi ajustado contra outras variáveis (para análise de regressão multivariada) e utilizado para balanceamento e pareamento de grupos, incluindo intervalos de idade, sexo , história de tabagismo, uso profilático de ivermectina, DM2, asma, DPOC, doenças cardiovasculares e outras doenças pulmonares, hipertensão, câncer atual (qualquer tipo) e história de acidente vascular cerebral e/ou infarto do miocárdio.
Antes do emparelhamento, foi empregado um modelo linear misto generalizado, assumindo a distribuição binomial para os resíduos e incluindo os efeitos classificatórios fixos de cada um desses parâmetros. Os intervalos de idade foram ajustados para avaliação do uso profilático de ivermectina como preditor independente de morte por COVID-19. Foram fornecidas probabilidades não ajustadas e multivariadas ajustadas por Poisson de sobreviver à COVID-19 (valor de p), de acordo com cada parâmetro.
PSM foi realizado para risco de mortalidade entre usuários de ivermectina e não usuários de ivermectina. A taxa de infecção por COVID-19 e o risco de morrer também foram calculados para as variáveis. Após o PSM, foi realizado um segundo ajuste (“duplo ajuste”) com regressão linear multivariada para variáveis residuais [33,34] .
Não houve dados faltantes, uma vez que o desenho do sistema de registro exigia que todas as variáveis de dados fossem preenchidas para serem formalmente incluídas no registro. Apenas dados inseridos erroneamente (ilógicos) foram encontrados. Nesses casos, uma revisão do prontuário médico foi realizada para obter dados precisos. O programa utilizado para a análise foi o Statistical Analysis Software (SAS/STAT) (SAS Institute Inc., Cary, NC). Por razões de transparência, dois conjuntos de dados dos 7.345 casos de COVID-19 e dos 113.845 sujeitos participantes considerados para a presente análise serão tornados públicos após publicação revisada por pares.
Resultados
Uma descrição detalhada dos dados considerados para a presente análise é ilustrada na Figura 1 . Dos 220.517 itajaís sem COVID-19 até 7 de julho de 2020, 159.561 tinham mais de 18 anos. Dos 159.561 cidadãos acima de 18 anos sem COVID-19 até 7 de julho de 2020, 113.845 (71,3% da população acima de 18 anos) receberam ivermectina antes de serem infectados pela COVID-19. Um total de 45.716 cidadãos (28,7%) não receberam ou não quiseram receber ivermectina durante o programa, inclusive como profilático ou como tratamento após contrair COVID-19.
Dos 113.845 indivíduos profilaxados da cidade de Itajaí, 4.197 tiveram RT-PCR SARS-CoV-2 positivo (3,7% de taxa de infecção), enquanto 3.034 dos 37.027 indivíduos não tratados tiveram RT-PCR SARS-CoV-2 positivo (6,6% taxa de infecção), uma redução de 44% na taxa de infecção por COVID-19 (taxa de risco [RR], 0,56; intervalo de confiança de 95% (IC 95%), 0,53-0,58; p < 0,0001). Outros 114 indivíduos que usaram ivermectina e foram infectados eram originários de outras cidades, mas foram cadastrados no programa, totalizando 4.311 casos positivos entre usuários de ivermectina. Para a presente análise foram considerados os 4.311 casos positivos entre indivíduos que usaram ivermectina e 3.034 casos entre indivíduos que não usaram ivermectina. Após o PSM, foram criadas duas coortes de 3.034 sujeitos.
As características iniciais dos 7.345 indivíduos incluídos antes do PSM e as características iniciais dos 6.068 indivíduos nos grupos correspondentes são mostradas na Tabela 1 . Antes do PSM, os usuários de ivermectina apresentavam maior percentual de indivíduos com mais de 50 anos (p < 0,0001), maior prevalência de DM2 (p = 0,0004), hipertensão (p < 0,0001) e DCV (p = 0,03) e maior percentual de caucasianos (p = 0,004), do que não usuários. Após PSM, todos os parâmetros basais foram semelhantes entre os grupos. A Figura 2 resume os principais achados deste estudo.
Taxas de hospitalização e mortalidade em usuários e não usuários de ivermectina em análise pareada por escore de propensão
Conforme descrito na Tabela 2 , após o emprego do PSM, dos 6.068 indivíduos (3.034 em cada grupo), houve 44 hospitalizações entre usuários de ivermectina (taxa de hospitalização de 1,6%) e 99 hospitalizações (taxa de hospitalização de 3,3%) entre não usuários de ivermectina, um Redução de 56% na taxa de hospitalização (RR, 0,44; IC 95%, 0,31-0,63). Quando o ajuste pelas variáveis foi empregado, a redução na taxa de hospitalização foi de 67% (RR, 0,33; IC 95%, 023-0,66; p < 0,0001).
Houve 25 mortes entre usuários de ivermectina (taxa de mortalidade de 0,8%) e 79 mortes entre não usuários de ivermectina (taxa de mortalidade de 2,6%), uma redução de 68% na taxa de mortalidade (RR, 0,32; IC 95%, 0,20-0,49). Quando o PSM foi ajustado, a redução na taxa de mortalidade foi de 70% (RR, 0,30; IC 95%, 0,19-0,46; p < 0,0001).
Determinantes da mortalidade por COVID-19 por meio de análise pareada por escore de propensão
A Tabela 3 descreve os fatores de risco resultantes para a morte por COVID-19 na população em geral através da análise do PSM. Os fatores de risco para mortalidade em COVID-19 incluíram envelhecimento (p < 0,0001), sexo masculino (p = 0,015), DM2 (p < 0,0001), hipertensão (p < 0,0001), asma (p = 0,011), DPOC (p < 0,0001). ), outras doenças pulmonares (p = 0,048), história de IM (p = 0,034) e história de acidente vascular cerebral (p < 0,0001). Para detectar fatores de risco independentes, o ajuste pós-PSM para variáveis mostrou que a ivermectina (p < 0,0001; redução de 70% no risco de mortalidade) e o sexo feminino (p = 0,022; redução de 38% no risco de mortalidade) eram protetores, enquanto DM2 (p = 0,041; aumento de 79% no risco de mortalidade), hipertensão (p = 0,008; aumento de 98% no risco de mortalidade) e, marginalmente, outras doenças pulmonares (p = 0,061; aumento de 468% no risco de mortalidade) e história de acidente vascular cerebral (p = 0,054; aumento de 97% no risco de mortalidade) foram identificados como fatores de risco independentes.
Em uma comparação das taxas de hospitalização por COVID-19 em toda a cidade antes e durante o programa, a mortalidade por COVID-19 diminuiu de 6,8% antes do programa com uso profilático de ivermectina para 1,8% após seu início (RR, 0,27; IC 95%, 0,21 -0,33; p < 0,0001) e na taxa de mortalidade por COVID-19, de 3,4% a 1,4% (RR, 0,41; IC 95%, 0,31-0,55; p < 0,0001) (Tabela 4 ) .
Discussão
Este programa prospectivo de profilaxia com ivermectina para COVID-19 em toda a cidade resultou em reduções significativas nas infecções, hospitalizações e mortes por COVID-19. Os não usuários de ivermectina tinham duas vezes mais probabilidade de morrer de COVID-19 do que os usuários de ivermectina na análise da população geral. Como os grupos foram comparados quanto à exposição durante o mesmo período, de maneira paralela, as mudanças nas taxas de transmissão afetariam igualmente usuários e não usuários de ivermectina.
A cidade de Itajaí, no estado de Santa Catarina, Brasil, iniciou um programa municipal de profilaxia com ivermectina em julho de 2020 como parte de diversas iniciativas para reduzir a carga da COVID-19. O uso da ivermectina baseou-se na literatura existente na época e na virtual ausência de riscos. O funcionamento do Sistema Único de Saúde (SUS) como suporte integral à saúde de toda a população permitiu à cidade estabelecer um programa populacional irrestrito. Esse programa contou com uma estrutura de apoio composta por um grande ambulatório localizado no Centro de Convenções de Itajaí. Este ambulatório tornou-se o principal local de atendimento aos pacientes com COVID-19, apoiado por vários serviços públicos onde médicos de clínica geral atendiam regularmente os pacientes.
O uso de ivermectina foi opcional, salvo contraindicação e a critério médico. Um programa estruturado de base médica com consulta médica e avaliação de características demográficas básicas e comorbidades ofereceu ivermectina como profilaxia opcional para aqueles que concordaram em participar deste programa de tratamento preventivo. O estado de saúde foi avaliado e os dados foram inseridos prospectivamente ao longo do período do programa, em sistema totalmente digitalizado disponibilizado pelo Sistema Único de Saúde (SUS). Como o sistema existia antes da pandemia, um número significativo da população já estava cadastrado com informações de saúde, incluindo doenças passadas e atuais, uso de medicamentos e outras características. As adaptações feitas no SUS para a preparação para a pandemia, antes do início deste programa ambulatorial de ivermectina, permitiram uma coleta estruturada e bem organizada dos dados que monitoraram quaisquer valores faltantes, reforçando a confiabilidade dos resultados.
Um importante viés conservador estava presente. Os principais fatores de risco para COVID-19 grave e mortalidade devido a COVID-19, incluindo envelhecimento, diabetes e hipertensão, estavam mais presentes entre os usuários de ivermectina, o que pode ter subestimado os benefícios da ivermectina, uma vez que foi demonstrado ser particularmente eficaz em indivíduos acima 49 anos em termos de redução do risco absoluto, que corresponde ao grupo de maior risco para COVID-19. Isto permite compreender que o uso profilático de ivermectina pode ser particularmente impactante em idosos. Além disso, a ivermectina pareceu reduzir o risco excessivo de hipertensão, DM2 e outras doenças.
De acordo com a literatura, indivíduos com maior idade, diabetes e sexo masculino tiveram menor probabilidade de sobreviver (p < 0,05 para todos), e apenas o envelhecimento permaneceu como fator de risco independente após PSM (p < 0,0001). No entanto, o uso profilático de ivermectina parece mitigar o risco adicional de morte por COVID-19 devido a DM2, hipertensão e doenças cardiovasculares.
A narrativa de que a utilização de terapias preventivas e de tratamento precoce fará com que as pessoas relaxem a sua cautela de permanecer social e fisicamente distanciadas para permitir mais infecções relacionadas com a COVID-19 não é apoiada aqui. Os dados deste estudo demonstram que o uso preventivo de ivermectina reduz significativamente a taxa de infecção e que os benefícios superam o especulado aumento do risco de mudanças nos comportamentos sociais. Assim, podemos especular que o uso profilático de ivermectina poderia desempenhar um papel importante na redução da carga pandémica.
Mesmo após ajustes para mensurar as variáveis mais relevantes que poderiam influenciar os desfechos relacionados à COVID-19, incluindo idade, sexo, comorbidades e hábitos, visando evitar superestimação dos efeitos da ivermectina e assemelhar-se a um ensaio clínico randomizado, a ivermectina profilática provou ser eficaz. ser protetor para a população em geral, com redução de 68% na taxa de mortalidade e p < 0,0001 após emprego do PSM.
A proteção conferida pela ivermectina quando usada profilaticamente para a COVID-19 pode ter refletido na redução das taxas de hospitalização e mortalidade por COVID-19 observadas em nível populacional. Em comparação com antes do início do programa, as taxas de hospitalização e mortalidade por COVID-19 foram reduzidas em 73% e 59%, respectivamente (p < 0,0001 para ambas). Essas reduções foram obtidas quando se considerou a população geral e o número de casos, internações e óbitos por COVID-19 na cidade de Itajaí, independentemente do percentual de pacientes em uso profilático de ivermectina. Não houve alterações nas variantes, infecciosidade e patogenicidade do SARS-CoV-2 antes e durante o programa.
Quando comparada com todas as outras grandes cidades do estado de Santa Catarina, as diferenças na taxa de mortalidade por COVID-19 antes de 7 de julho de 2020 e entre 7 de julho de 2020 e 21 de dezembro de 2020, Itajaí ficou em primeiro lugar [35 ] . Estes resultados indicam que a prescrição médica opcional e a ivermectina coberta em toda a cidade podem ter um impacto positivo no sistema de saúde. No entanto, os presentes resultados não fornecem suporte suficiente para a hipótese de que a ivermectina possa ser uma alternativa às vacinas contra a COVID-19.
Devido ao grande número de participantes, este programa municipal não foi capaz de supervisionar se os usuários de ivermectina estavam usando ivermectina regularmente, embora o número acumulado de comprimidos de ivermectina fosse estritamente controlado. Isto ocorreu como um potencial viés conservador, uma vez que os efeitos da ivermectina na profilaxia poderiam ser subestimados devido à adesão à frequência recomendada de uso de ivermectina.
Embora a ivermectina seja um medicamento multialvo [36] , seus benefícios máximos ocorrem quando está presente em uma concentração mínima em uma ampla variedade de locais para inibir múltiplas vias metabólicas e inflamatórias. Porém, embora a dose de ivermectina empregada no programa tenha sido menor que o mínimo para atingir a concentração necessária para atuar nesses múltiplos locais, a redução da infecção, da mortalidade e das taxas de mortalidade no grupo infectado que utilizou ivermectina profilaticamente foi surpreendentemente menor. A ivermectina acumulada ou de longo prazo também pode desempenhar um papel crítico na sua proteção a longo prazo contra a COVID-19.
Limitações
Sendo um estudo observacional prospectivo que permitiu aos indivíduos auto-selecionarem entre tratamento e não tratamento, em vez de confiar na randomização, fatores de confusão importantes podem ter estado diferencialmente presentes, o que poderia explicar as diferenças observadas. Dado que os benefícios medidos ocorreram apesar dos factores de risco negativos estarem mais presentes no grupo de tratamento, isto sugere que os benefícios são provavelmente precisos e imparciais. Além disso, estudos que se baseiam em técnicas de PSM demonstraram concordar consistentemente com aqueles que empregam a randomização [37,38] , apoiando novamente a probabilidade de que os benefícios medidos sejam precisos. O tipo de SARS-CoV-2 predominante na cidade era desconhecido devido à falta de vigilância da genotipagem durante o período do programa. Não está claro se a profilaxia proposta neste programa seria tão eficaz em outras variantes do SARS-CoV-2. Além disso, não houve controle rigoroso sobre se os indivíduos infectados usaram algum medicamento específico em caso de infecção por COVID-19, e isso permite a possibilidade de que as diferenças possam ser explicadas por diferenças no uso de ivermectina ou outros medicamentos como tratamento.
Discussão final
Neste programa de profilaxia com ivermectina em toda a cidade, foi observada uma diminuição grande e estatisticamente significativa na taxa de mortalidade após o início do programa entre toda a população de residentes da cidade. Ao comparar indivíduos que usaram ivermectina regularmente, os não usuários tiveram duas vezes mais probabilidade de morrer de COVID-19, enquanto os usuários de ivermectina tiveram 7% menos probabilidade de serem infectados pelo SARS-CoV-2 (p = 0,003).
Embora este estudo não seja um ensaio clínico randomizado, duplo-cego e controlado por placebo, os dados foram coletados prospectivamente e resultaram em uma amostra massiva do estudo que permitiu o ajuste para vários fatores de confusão, fortalecendo assim os achados do presente estudo.
Devido ao perfil de segurança bem estabelecido e de longo prazo da ivermectina, com efeitos adversos raros, à ausência de opções terapêuticas comprovadas para prevenir a morte causada por COVID-19 e à falta de eficácia das vacinas em análises reais de mortalidade por todas as causas até à data, recomendamos que a ivermectina seja considerada como uma estratégia preventiva, em particular para aqueles com maior risco de complicações da COVID-19 ou com maior risco de contrair a doença, não como um substituto das vacinas contra a COVID-19, mas como um ferramenta adicional, especialmente durante períodos de altas taxas de transmissão.
Conclusões
Em um programa de ivermectina em toda a cidade com uso profilático e opcional de ivermectina para COVID-19, a ivermectina foi associada a taxas significativamente reduzidas de infecção, hospitalização e mortalidade por COVID-19.
Referências
- Chen IS, Kubo Y: Ivermectina e suas moléculas alvo: mecanismos de modulação compartilhados e únicos de canais iônicos e receptores pela ivermectina . J Fisiol. 2018, 596:1833-45. 10.1113/JP275236
- Kaur H, Shekhar N, Sharma S, Sarma P, Prakash A, Medhi B: Ivermectina como um medicamento potencial para o tratamento de COVID-19: uma revisão sincronizada com atributos clínicos e computacionais . 2021, 73:736-49. 10.1007/s43440-020-00195-y
- Martin RJ, Robertson AP, Choudhary S: Ivermectina: um anti-helmíntico, um inseticida e muito mais . Tendências Parasitol. 2021, 37:48-64. 10.1016/j.pt.2020.10.005
- Mastrangelo E, Pezzullo M, De Burghgraeve T, et al.: A ivermectina é um potente inibidor da replicação de flavivírus visando especificamente a atividade da helicase NS3: novas perspectivas para um medicamento antigo . J Quimioterapia Antimicrobiana. 2012, 67:1884-94. 10.1093/jac/dks147
- Wagstaff KM, Sivakumaran H, Heaton SM, Harrich D, Jans DA: A ivermectina é um inibidor específico da importação nuclear mediada por importina α/β capaz de inibir a replicação do HIV-1 e do vírus da dengue . Biochem J. 2012, 443:851-6. 10.1042/BJ20120150
- "Crump A: Ivermectina: droga 'maravilha' enigmática e multifacetada continua a surpreender e superar as expectativas" . J Antibiot (Tóquio). 2017, 70:495-505. 10.1038/ja.2017.11
- Heidary F, Gharebaghi R: Ivermectina: uma revisão sistemática dos efeitos antivirais ao regime complementar COVID-19 . J Antibiot (Tóquio). 2020, 73:593-602. 10.1038/s41429-020-0336-z
- Li N, Zhao L, Zhan X: A proteômica quantitativa revela uma propriedade antiviral de amplo espectro da ivermectina, beneficiando o tratamento de COVID-19 . J Cell Physiol. 2021, 236:2959-75. 10.1002/jcp.30055
- Jin L, Feng X, Rong H, et al.: O medicamento antiparasitário ivermectina é um novo ligante de FXR que regula o metabolismo . Nat Comun. 2013, 4:1937. 10.1038/ncomms2924
- Yang JS, Qi W, Farias-Pereira R, Choi S, Clark JM, Kim D, Park Y: Permetrina e ivermectina modulam o metabolismo lipídico em hepatócitos HepG2 induzidos por esteatose . Toxicol Químico Alimentar. 2019, 125:595-604. 10.1016/j.fct.2019.02.005
- Cairns DM, Giordano JE, Conte S, Levin M, Kaplan DL: A ivermectina promove a regeneração dos nervos periféricos durante a cicatrização de feridas . ACS Ômega. 2018, 3:12392-402. 10.1021/acsomega.8b01451
- Zheng YY, Ma YT, Zhang JY, Xie X: COVID-19 e o sistema cardiovascular . Nat Rev Cardiol. 2020, 17:259-60. 10.1038/s41569-020-0360-5
- Nagai H, Satomi T, Abiru A, et al.: Efeitos anti-hipertróficos de pequenas moléculas que mantêm os níveis de ATP mitocondrial sob hipóxia . EBioMedicina. 2017, 24:147-58. 10.1016/j.ebiom.2017.09.022
- Park A, Iwasaki A: Interferons tipo I e tipo III - indução, sinalização, evasão e aplicação no combate ao COVID-19 . Micróbio hospedeiro celular. 2020, 27:870-8. 10.1016/j.chom.2020.05.008
- Zhang X, Song Y, Ci X, et al.: A ivermectina inibe a produção de citocinas inflamatórias induzida por LPS e melhora a sobrevivência induzida por LPS em camundongos . Inflamm Res. 2008, 57:524-9. 10.1007/s00011-008-8007-8
- Okeahialam BN: Os inibidores da serina protease podem ser benéficos no tratamento da doença COVID-19 . O Adv Infect Dis. 2021, 8: 10.1177/20499361211032048
- Matsuyama T, Kubli SP, Yoshinaga SK, Pfeffer K, Mak TW: Uma via STAT aberrante é central para COVID-19 . A morte celular difere. 2020, 27:3209-25. 10.1038/s41418-020-00633-7
- Wang K, Gao W, Dou Q, Chen H, Li Q, Nice EC, Huang C: A ivermectina induz autofagia citostática mediada por PAK1 no câncer de mama . Autofagia. 2016, 12:2498-9. 10.1080/15548627.2016.1231494
- Dou Q, Chen HN, Wang K, et al.: A ivermectina induz autofagia citostática bloqueando o eixo PAK1/Akt no câncer de mama . Câncer Res. 2016, 76:4457-69. 10.1158/0008-5472.CAN-15-2887
- Layhadi JA, Turner J, Crossman D, Fountain SJ: ATP evoca respostas de Ca2 + e secreção de CXCL5 via ativação do receptor P2X4 em macrófagos derivados de monócitos humanos . J Imunol. 2018, 200:1159-68. 10.4049/jimunol.1700965
- Juarez M, Schcolnik-Cabrera A, Dueñas-Gonzalez A: O medicamento multialvo ivermectina: de um agente antiparasitário a um medicamento contra o câncer reposicionado . Sou J Câncer Res. 2018, 8:317-31.
- Andersson U, Ottestad W, Tracey KJ: HMGB1 extracelular: um alvo terapêutico na inflamação pulmonar grave, incluindo COVID-19? . Mol Med. 2020, 26h42. 10.1186/s10020-020-00172-4
- Yan S, Ci X, Chen N, et al .: Efeitos antiinflamatórios da ivermectina em modelo de asma alérgica em camundongos . Inflamm Res. 2011, 60:589-96. 10.1007/s00011-011-0307-8
- Reis TA, Oliveira-da-Silva JA, Tavares GS, et al.: A ivermectina apresenta atividade antileishmaníaca eficaz e seletiva in vitro e in vivo contra Leishmania infantum e é terapêutica contra leishmaniose visceral . Exp Parasitol. 2021, 221:108059. 10.1016/j.exppara.2020.108059
- Esquema D: Ivermectina para tratamento de COVID-19: resposta clínica em doses quase-limiares por meio do alívio hipotético da oclusão vascular mediada por CD147. [PRÉ-IMPRESSÃO] . SSRN J. 2020, 10.2139/ssrn.3636557
- "Ci X, Li H, Yu Q, et al.: A avermectina exerce efeito antiinflamatório ao regular negativamente o fator de transcrição nuclear kappa-B e a via de ativação da proteína quinase ativada por mitógeno" . Fundam Clin Pharmacol. 2009, 23:449-55. 10.1111/j.1472-8206.2009.00684.x
- Zaidi AK, Dehgani-Mobaraki P: Os mecanismos de ação da ivermectina contra SARS-CoV-2: um artigo de revisão clínica baseado em evidências. [PRÉ-IMPRESSÃO] . J Antibiot (Tóquio). 2021, 10.1038/s41429-021-00430-5
- Kalfas S, Visvanathan K, Chan K, Drago J: O potencial terapêutico da ivermectina para COVID-19: uma revisão sistemática de mecanismos e evidências. [PRÉ-IMPRESSÃO] . medRxiv. 2020, 10.1101/2020.11.30.20236570
- Behera P, Patro BK, Singh AK, et al.: Papel da ivermectina na prevenção da infecção por SARS-CoV-2 entre profissionais de saúde na Índia: um estudo de caso-controle correspondente . PLoS Um. 2021, 16:e0247163. 10.1371/journal.pone.0247163
- Hellwig MD, Maia A: Uma profilaxia COVID-19? Menor incidência associada à administração profilática de ivermectina . Agentes Antimicrobianos Int J. 2021, 57:106248. 10.1016/j.ijantimicag.2020.106248
- Associação Médica Mundial. Declaração de Helsínquia . (2020). Acesso: 24 de dezembro de 2021: https://www.wma.net/what-we-do/medical-ethics/declaration-of-helsinki/doh-oct2000/ .
- Conselho Federal de Medicina (CFM). Código de Ética Médica . (2010). Acesso: 24 de dezembro de 2021: https://portal.cfm.org.br/images/stories/biblioteca/codigo%20de%20etica%20medica.pdf .
- Nguyen TL, Collins GS, Spence J, Daurès JP, Devereaux PJ, Landais P, Le Manach Y: Ajuste duplo na análise de correspondência de escore de propensão: escolhendo um limite para considerar o desequilíbrio residual . Método BMC Med Res. 2017, 17:78. 10.1186/s12874-017-0338-0
- Zhang Z, Kim HJ, Lonjon G, Zhu Y: Diagnóstico de equilíbrio após correspondência de escore de propensão . Ann Transl Med. 2019, 7h16. 10.21037/atm.2018.12.10
- Boletim epidemiológico do estado de Santa Catarina, Brasil . (2020). Acesso: 24 de dezembro de 2021: http://www.dive.sc.gov.br .
- Choudhury A, Das NC, Patra R, Bhattacharya M, Ghosh P, Patra BC, Mukherjee S: Explorando a eficácia de ligação da ivermectina contra as proteínas-chave da patogênese do SARS-CoV-2: uma abordagem in silico . Virol futuro. 2021, 16:277-91. 10.2217/fvl-2020-0342
- Austin PC: Uma introdução aos métodos de pontuação de propensão para reduzir os efeitos de confusão em estudos observacionais . Res. de comportamento multivariado. 2011, 46:399-424. 10.1080/00273171.2011.568786
- Correspondência de escore de propensão na ausência de ensaios clínicos randomizados: um estudo de caso sobre os efeitos da amamentação na obesidade infantil . (2020). Acessado em: 24 de dezembro de 2021: https://methods.sagepub.com/case/propensity-score-matching-trials-effects-breastfeeding-childhood-obesity .
Apêndices
Índice
Lista de verificação STROBE…………………………………………………………………………
Análise incomparável de pacientes infectados…………………….………………………………
Determinantes da mortalidade por COVID-19 antes da correspondência…………………………………
Usuários de ivermectina versus não usuários de ivermectina em subpopulações……………….……………
Análise incomparável.................................................................................................
Análise de correspondência de pontuação de propensão………………………………………….………….
Modificação do protocolo para cálculo das taxas de infecção…………………………….
Lista de verificação STROBE
A Tabela 5 descreve a lista de verificação STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) deste estudo.
Análise incomparável de pacientes infectados
A Tabela 6 compara as taxas de hospitalização e mortalidade de pacientes infectados por COVID-19 entre usuários e não usuários de ivermectina. Dos 7.345 indivíduos com COVID-19, ocorreram 185 internações (taxa de internação de 2,52%) entre os não usuários. Dos 4.311 usuários de ivermectina, ocorreram 86 internações (taxa de internação de 2,0%), enquanto entre os 3.034 não usuários de ivermectina, ocorreram 99 internações (taxa de internação de 3,3%), com redução da taxa de internação por COVID-19 de 39. % (RR, 0,61; IC 95%, 0,46-0,81; p = 0,0007). Após ajuste pelas variáveis, a redução na taxa de internação foi de 59% (RR < 0,41; IC 95%, 0,31-0,55; p < 0,0001).
Entre os 7.345 indivíduos de ambos os grupos com COVID-19, ocorreram 141 mortes (taxa de mortalidade de 1,9%). Entre os 4.311 usuários de ivermectina, ocorreram 62 mortes (taxa de mortalidade de 1,4%), enquanto entre os 3.034 indivíduos que não usaram ivermectina profilaticamente, ocorreram 79 mortes (taxa de mortalidade de 2,6%), com redução na taxa de mortalidade de 45% ( RR, 0,55; IC 95%, 0,40-0,77; p = 0,0004). Quando ajustada para variáveis residuais, a redução na taxa de mortalidade por COVID-19 foi de 57% (RR, 0,43; IC 95%, 0,32-0,59; p < 0,0001).
Determinantes da mortalidade por COVID-19 antes da correspondência
A Tabela 7 descreve os fatores de risco associados à morte na população geral antes do PSM. Em análise sem correspondência, os fatores de risco não ajustados para COVID-19 entre todos os participantes incluíram não usuários de ivermectina (p = 0,0004), idade (p < 0,0001), sexo (p = 0,014), DM2 (p < 0,0001), hipertensão (p < 0,0001), hipertensão (p < 0,0001). 0,0001), asma (p = 0,041), DPOC (p < 0,0001), câncer (geral) (p = 0,004), DCV (p < 0,0001), outras doenças pulmonares além de asma e DPOC (p = 0,003) e história de acidente vascular cerebral (p < 0,0001). Após ajuste pelas variáveis, não usuárias de ivermectina (p < 0,0001), idade (p < 0,0001), sexo (p = 0,002), raça (p = 0,052), DT2 (p = 0,008) e outras doenças pulmonares além de asma e A DPOC (p = 0,024) demonstrou ser fator de risco.
Usuários de ivermectina versus não usuários de ivermectina em subpopulações
As Tabelas 8 , 9 retratam as diferenças na taxa de mortalidade em diferentes subpopulações de usuários de ivermectina e não usuários de ivermectina, e comparam as taxas de mortalidade em cada subpopulação entre usuários e não usuários de ivermectina, antes e depois da correspondência, respectivamente.
Análise incomparável
Antes do pareamento (Tabela 8 ), os valores não ajustados mostraram que os fatores de risco para usuários e não usuários de ivermectina eram envelhecimento (p < 0,0001 para ambos), DM2 (p < 0,0001 para ambos), hipertensão (p < 0,0001 para ambos), DCV (p = 0,003 e p = 0,012, respectivamente), DPOC (p < 0,0001 e p = 0,042, respectivamente), outras doenças pulmonares (p = 0,041 e p = 0,009, respectivamente) e história de acidente vascular cerebral (p = 0,0001 e p < 0,0001, respectivamente). Sexo masculino e câncer foram fatores de risco para usuários de ivermectina (p = 0,044 e p = 0,22, respectivamente). História de IM foi fator de risco para não usuários de ivermectina (p = 0,009).
Após ajuste para variáveis, os fatores de risco independentes restantes incluem envelhecimento para usuários de ivermectina (p < 0,0001) e não usuários (p < 0,0001), sexo masculino para não usuários (p = 0,012) e DM2 para não usuários de ivermectina ( p = 0,024).
As taxas de mortalidade entre usuários de ivermectina foram estatisticamente menores do que entre os não usuários nos seguintes grupos: entre 31 e 49 anos (RR, 0,15; IC 95%, 0,03-0,68; p = 0,014), acima de 50 anos (RR, 0,41; IC 95%, 0,30-0,57; p < 0,0001), sexo masculino (RR, 0,60; IC 95%, 0,39-0,94; p = 0,024), sexo feminino (RR, 0,50; IC 95%, 0,30-0,82; p = 0,006), caucasianos (RR, 0,52; IC 95%, 0,36-0,76; p = 0,0007), indivíduos com DM2 (RR, 0,29; IC 95%, 0,14-0,58; p = 0,0006), com hipertensão (RR, 0,33; IC 95%, 0,19-0,57; p = 0,0001), e indivíduos sem hipertensão, DM2, DPOC, asma, outras doenças pulmonares, DCV, história de infarto do miocárdio, história de acidente vascular cerebral e não fumantes (RR, 0,54-0,61; 95 IC %, 0,19-0,91; p = 0,0003 a 0,017).
A redução relativa da taxa de risco de mortalidade com o uso de ivermectina foi mais substancial naqueles com grandes comorbidades comuns, incluindo DT2 (redução de 71% entre indivíduos com DT2 versus redução de 42% entre indivíduos sem DT2), hipertensão (redução de 67% na mortalidade por COVID-19). taxa entre indivíduos com hipertensão versus redução de 39% entre indivíduos sem hipertensão), asma (redução de 70% na taxa de mortalidade por COVID-19 entre indivíduos com asma versus 45% entre indivíduos sem asma) e história de IM (redução de 86% na Taxa de mortalidade por COVID-19 entre indivíduos com histórico de IM versus 44% entre indivíduos sem histórico de IM). A redução do risco de morte foi maior em mulheres (50%) do que em homens (40%), em caucasianos (48%) do que em mestiços (37%) e afro-brasileiros (31%), e entre 30 e 50 anos. anos (85%) do que acima de 50 anos (59%). No entanto, a redução absoluta do risco foi maior entre aqueles com mais de 50 anos (6,6 pontos percentuais [pp]) do que aqueles entre 30 e 50 anos (0,5 pp) e abaixo de 30 anos (0,1 pp).
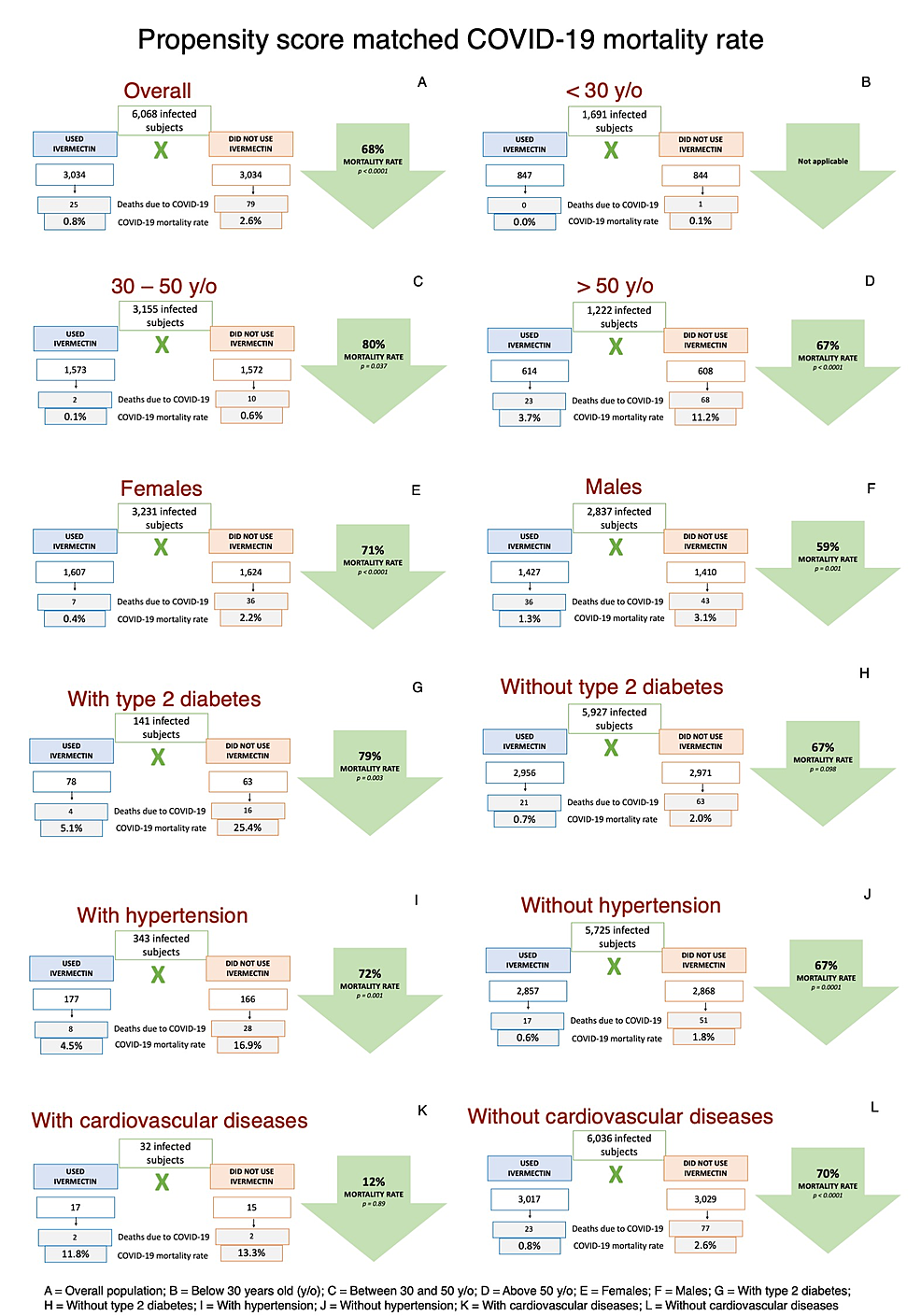
Análise correspondente à pontuação de propensão
A Tabela 9 descreve as taxas de mortalidade correspondentes ao escore de propensão em subpopulações de usuários de ivermectina e não usuários de ivermectina e, em seguida, compara usuários e não usuários de ivermectina para cada característica. A Figura 3 ilustra as taxas de mortalidade por COVID-19 em subpopulações após correspondência. As taxas de mortalidade pós-correspondência, as razões de risco e os valores de p entre os não usuários de ivermectina permaneceram os mesmos de antes da correspondência. Entre os usuários de ivermectina, os valores foram os seguintes: idade avançada (p < 0,0001), sexo masculino (p = 0,017), DT2 (p = 0,0002), hipertensão (p < 0,0001), DCV (p = 0,0001), asma (p = 0,026), DPOC (p = 0,0001) e história de acidente vascular cerebral (p < 0,0001). Não houve mortes em usuários de ivermectina com outras doenças pulmonares, câncer e histórico de infarto do miocárdio.
Após o PSM, a razão entre as taxas de mortalidade de usuários de ivermectina e não usuários de ivermectina mostrou redução estatística na taxa de mortalidade com o uso de ivermectina em indivíduos acima de 30 anos (30-50 anos; RR, 0,20; IC 95%, 0,04-0,91; p = 0,037; >50 anos; RR, 0,33; IC 95%, 0,21-0,53; p < 0,0001), em ambos os sexos (sexo masculino; RR, 0,41; IC 95%, 0,24-0,71; p = 0,001; feminino sexo; RR, 0,29; IC 95%, 0,18-0,46; p < 0,0001), caucasianos (RR, 0,28; IC 95%, 0,16-0,46; p < 0,0001), indivíduos com DM2 (RR, 0,21; IC 95%, 0,07-0,59; p = 0,003), com hipertensão (RR, 0,28; IC 95%, 0,13-0,61; p = 0,001) e indivíduos sem hipertensão, DT2, DPOC, asma, outras doenças pulmonares, DCV, história de IM, história de acidente vascular cerebral e não fumantes (RR, 0,30-0,32; IC 95%, 0,19-0,58; p < 0,0001 para todos, exceto sem diabetes, p = 0,098).
Após o emparelhamento, as reduções relativas no risco de mortalidade com o uso de ivermectina foram ligeiramente maiores em indivíduos com DM2 (redução de 79% e 67% entre indivíduos com DM2 e sem DM2, respectivamente) e hipertensão (redução de 72% e 67% na COVID-19). taxa de mortalidade em indivíduos com e sem hipertensão, respectivamente), mas não com outras comorbidades. A redução absoluta do risco foi maior entre aqueles com mais de 50 anos, de 75 indivíduos salvos para cada 1.000 indivíduos infectados com COVID-19 (7,5 pp) do que aqueles entre 30 e 50 anos (0,5 pp; cinco indivíduos salvos para cada 1.000 indivíduos com COVID-19). 19 casos) e menores de 30 anos (0,1 pp; um sujeito salvo para cada 1.000 casos de COVID-19).
Modificação do protocolo para cálculo das taxas de infecção
Anteriormente, havíamos considerado toda a população de Itajaí como fonte para o cálculo dos não usuários de ivermectina, o que elevou falsamente o número de não usuários e, consequentemente, reduziu falsamente a taxa de infecção entre os não usuários de ivermectina. Também foram excluídos sujeitos menores de 18 anos e participantes de outras cidades, uma vez que seus desfechos não seriam contabilizados nas estatísticas da cidade de Itajaí. A Figura 4 resume as modificações.

Nenhum comentário:
Postar um comentário